Nicht-invasive Behandlung von Lebertumoren durch das britische Innovative Devices Access Pathway (IDAP) anerkannt
HistoSonics gab heute bekannt, dass sein Edison Histotripsy System zur nicht-invasiven Zerstörung von Lebertumoren in Großbritannien im Rahmen einer Unmet Clinical Need Authorisation (UCNA) einen kontrollierten frühen begrenzten Marktzugang erhalten hat. Diese Zulassung, die im Rahmen des britischen Programms "Innovative Devices Access Pathway" (IDAP) erteilt wurde, ermöglicht bestimmten Patienten mit Lebertumoren einen kontrollierten frühen Zugang zur Histotripsy und stellt einen bedeutenden Meilenstein bei der Erweiterung der Behandlungsmöglichkeiten für eine der dringendsten ungedeckten medizinischen Bedürfnisse in der Onkologie im Vereinigten Königreich dar.
Diese Pressemitteilung enthält multimediale Inhalte. Die vollständige Mitteilung hier ansehen: https://www.businesswire.com/news/home/20250529153215/de/
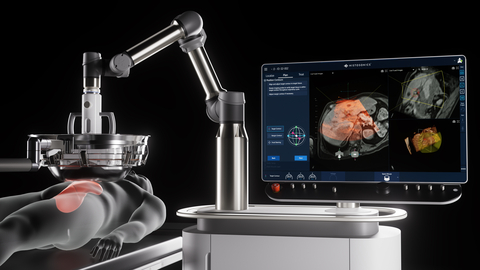
HistoSonics Non-Invasive Edison Histotripsy System
Das IDAP-Programm, das von der britischen Regierung ins Leben gerufen wurde, um transformative medizinische Technologien schneller in das Gesundheitssystem zu bringen, wählte das Edison-System aufgrund des Potenzials der Histotripsie, die aktuellen und zukünftigen Gesundheitsbedürfnisse Großbritanniens sinnvoll zu adressieren, als eines von nur acht verfügbaren Anträgen für 2024 aus. Nach einem strengen Bewertungsverfahren kam die britische Aufsichtsbehörde für Medizinprodukte (Medicines and Healthcare products Regulatory Agency, MHRA) zu dem Schluss, dass unsere Histotripsie-Geräte über eine UCNA verfügbar gemacht werden können, und hob den wichtigen Beitrag hervor, den dieses Gerät für die öffentliche Gesundheit von Patienten mit primären oder metastasierten Lebertumoren leisten kann.
Das Edison-System ist die erste und einzige Plattform, die Histotripsie, eine nicht-thermische, nicht-invasive fokussierte Ultraschalltechnologie, einsetzt, um Tumore ohne Operation, Bestrahlung oder systemische Therapien mechanisch zu verflüssigen. Das Gerät erhielt im Oktober 2023 die De-Novo-Zulassung der US-amerikanischen Food and Drug Administration (FDA). Die HistoSonics-Plattform ermöglicht Ärzten auf einzigartige Weise die Planung, Zielgenauigkeit, Behandlung und Überwachung der Tumorzerstörung mit kontinuierlicher Echtzeit-Visualisierung und -Kontrolle und bietet damit eine beispiellose Kontrolle und Präzision, die von keiner anderen bestehenden Methode erreicht wird.
"Die Sicherung des kontrollierten Zugangs in Großbritannien durch das IDAP-Pilotprogramm ist ein enormer Meilenstein für HistoSonics und ein klares Zeichen für die Anerkennung des Potenzials unserer Technologie, das Gesundheitswesen zu verändern", sagte Mike Blue, Präsident und CEO von HistoSonics. "Wir fühlen uns geehrt, mit dem NHS und den britischen Regulierungs- und Zugangspartnern zusammenzuarbeiten, um die Histotripsie Patienten in ganz Großbritannien zugänglich zu machen, von denen viele nur über begrenzte Optionen verfügen. Dieser Fortschritt baut auf unserer starken klinischen Erfolgsbilanz in den USA und unserer weltweit wachsenden Basis an klinischen Nachweisen auf."
Nach der De-Novo-Zulassung durch die FDA im Oktober 2023 wurde das Edison-System in großen akademischen Zentren und Krankenhäusern in den gesamten USA eingeführt, darunter integrierte Gesundheitssysteme und kommunale Krankenhäuser, die ebenfalls bestrebt sind, ihren Patienten diese bahnbrechende, nicht-invasive Behandlung anzubieten. Weitere klinische Studien sind im Gange, um den Einsatz der Histotripsie auf weitere Indikationen auszuweiten, darunter die nicht-invasive Behandlung von Nierentumoren (HOPE4KIDNEY-Studie NCT05820087) und Bauchspeicheldrüsentumoren (GANNON-Studie NCT06282809), bevor die Zulassungsanträge für beide Indikationen eingereicht werden.
Das Unternehmen ist davon überzeugt, dass die engen klinischen Beziehungen innerhalb des Vereinigten Königreichs, die durch mehrere wegweisende klinische Studien in den Bereichen Leber und Niere in den vergangenen Jahren aufgebaut wurden, dazu beitragen werden, die Einführung der Histotripsie in den großen britischen Gesundheitszentren zu beschleunigen.
Im Rahmen der UCNA-Zulassung wird HistoSonics mit der MHRA zusammenarbeiten, um die Patientenergebnisse zu bewerten und im Rahmen eines Post-Market-Surveillance-Programms regelmäßig Daten aus der Praxis zur Leistung und Sicherheit des Geräts zu sammeln und zu analysieren. HistoSonics strebt gleichzeitig die europäische Zulassung im Rahmen des europäischen Konformitätsverfahrens (CE-Kennzeichnung) an, die eine breitere kommerzielle Verfügbarkeit in Großbritannien und Europa ermöglichen wird.
Verwendungszweck in Großbritannien:
Das Edison-System ist für die nicht-invasive mechanische Zerstörung von Lebertumoren bestimmt, einschließlich der teilweisen oder vollständigen Zerstörung von inoperablen Lebertumoren mittels Histotripsie. Dazu gehören Malignome im Zusammenhang mit primärem Leberkrebs und Fälle von metastasierenden Erkrankungen in der Leber. Das Gerät darf nur von Personen verwendet werden, die eine Schulung durch HistoSonics Inc. absolviert haben, und seine Verwendung muss unter der Aufsicht eines entsprechend geschulten Arztes erfolgen. Benutzer müssen diese Gebrauchsanweisung lesen, um die Warnhinweise, Vorsichtsmaßnahmen und die Zusammenfassung der klinischen Studien, einschließlich der gemeldeten unerwünschten Ereignisse, zu verstehen.
Das Edison-System wurde nicht für die Behandlung einer bestimmten Krankheit, einschließlich, aber nicht beschränkt auf Krebs, evaluiert, und es wurden keine spezifischen Krebsergebnisse (wie lokale Tumorprogression, 5-Jahres-Überlebensrate oder Gesamtüberlebensrate) evaluiert.
Erklärung zur bestimmungsgemäßen Verwendung in den Vereinigten Staaten:
Das Edison-System ist für die nicht-invasive mechanische Zerstörung von Lebertumoren bestimmt, einschließlich der teilweisen oder vollständigen Zerstörung von inoperablen Lebertumoren mittels Histotripsie. Die FDA hat das Edison-System nicht für die Behandlung von Krankheiten, einschließlich, aber nicht beschränkt auf Krebs, oder für bestimmte Krebsergebnisse (wie lokale Tumorprogression, 5-Jahres-Überlebensrate oder Gesamtüberlebensrate) bewertet. Das System darf nur von Ärzten verwendet werden, die eine Schulung von HistoSonics absolviert haben, und seine Verwendung muss unter der Aufsicht eines entsprechend geschulten Arztes erfolgen. Eine vollständige Liste der Warnhinweise, Vorsichtsmaßnahmen und eine Zusammenfassung der Ergebnisse klinischer Studien, einschließlich gemeldeter unerwünschter Ereignisse, finden Sie in der Gebrauchsanweisung des Geräts.
Über HistoSonics
HistoSonics ist ein privat geführtes Medizintechnikunternehmen, das eine nicht-invasive Plattform und eine proprietäre Schallstrahltherapie entwickelt, die auf der Wissenschaft der Histotripsie basiert, einem neuartigen Wirkmechanismus, bei dem fokussierter Ultraschall eingesetzt wird, um unerwünschtes Gewebe und Tumore mechanisch zu zerstören und zu verflüssigen. Das Unternehmen konzentriert sich derzeit auf die Vermarktung seines Edison-Systems in den USA und ausgewählten globalen Märkten für die Leberbehandlung und erweitert gleichzeitig die Anwendungen der Histotripsie auf andere Organe wie Niere, Bauchspeicheldrüse und andere. HistoSonics hat Niederlassungen in Ann Arbor, Michigan, und Minneapolis, Minnesota. Weitere Informationen zum Edison Histotripsie-System finden Sie unter: www.histosonics.com/. Patientenbezogene Informationen finden Sie unter: www.myhistotripsy.com/.
"The HOPE4LIVER single-arm pivotal trial for histotripsy of primary and metastatic liver tumors: 1-year update of clinical outcomes", veröffentlicht in Annals of Surgery von Ziemlewicz et al. ist unter CC BY-NC-ND lizenziert.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Originalversion auf businesswire.com ansehen: https://www.businesswire.com/news/home/20250529153215/de/
Contacts:
Für Medienanfragen
Medienkontakt:
Josh King
Vice President of Marketing
E-Mail: Joshua.king@histosonics.com
Telefon: 608.332.8124
Kimberly Ha
KKH Advisors
917-291-5744
kimberly.ha@kkhadvisors.com
