- DAZALS hat seinen primären Endpunkt, eine Verbesserung der Ergebnisse auf der ALS Functional Rating Scale-Revised (ALSFRS-R) bei Patienten, die Dazucorilant erhielten, im Vergleich zu Patienten, die Placebo erhielten, nicht erreicht
- DAZALS erreichte seinen sekundären Endpunkt einer verbesserten Gesamtüberlebensrate in Woche 24 der Studie bei Patienten, die 300 mg Dazucorilant erhielten, im Vergleich zu Patienten, die Placebo erhielten
- Eine explorative Analyse nach einem Jahr zeigt eine anhaltende signifikante Verbesserung der Gesamtüberlebensrate bei Patienten, die 300 mg Dazucorilant erhielten, im Vergleich zu Patienten, die nur Placebo erhielten
- Corcept bittet die US-amerikanischen und europäischen Zulassungsbehörden um Beratung hinsichtlich des optimalen weiteren Vorgehens
Corcept Therapeutics Incorporated (NASDAQ: CORT), ein kommerzielles Unternehmen, das sich mit der Erforschung und Entwicklung von Medikamenten zur Behandlung schwerer endokrinologischer, onkologischer, metabolischer und neurologischer Erkrankungen durch Modulation der Wirkung des Hormons Cortisol befasst, hat auf der Jahrestagung 2025 des European Network to Cure ALS (ENCALS) Ergebnisse seiner DAZALS-Studie mit Dazucorilant bei Patienten mit ALS vorgestellt. Die Präsentation finden Sie hier
Diese Pressemitteilung enthält multimediale Inhalte. Die vollständige Mitteilung hier ansehen: https://www.businesswire.com/news/home/20250605453863/de/
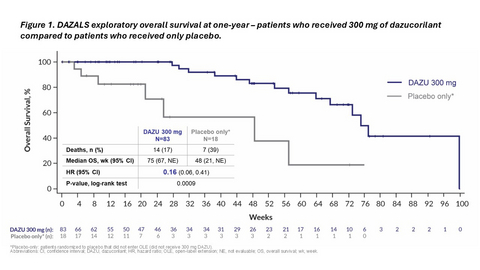
Figure 1. DAZALS exploratory overall survival analysis at one-year patients who received 300 mg of dazucorilant compared to patients who received only placebo.
DAZALS ist eine randomisierte, doppelblinde, placebokontrollierte Phase-2-Studie, in der 249 ALS-Patienten randomisiert entweder 150 mg Dazucorilant, 300 mg Dazucorilant oder Placebo täglich über einen Zeitraum von 24 Wochen erhielten. Patienten, die die Behandlungsdauer abgeschlossen hatten, konnten an einer Langzeit-Verlängerungsstudie teilnehmen, in der alle Patienten 300 mg Dazucorilant erhielten. Der primäre Endpunkt in DAZALS war der Unterschied im ALSFRS-R zwischen Patienten, die Dazucorilant erhielten, und denen, die Placebo erhielten. Die Gesamtüberlebensrate war ein sekundärer Endpunkt.
Obwohl DAZALS den primären Endpunkt nicht erreichte, verbesserte sich die Überlebensrate der Patienten signifikant. In Woche 24 der Studie waren bei den 83 Patienten, die 300 mg Dazucorilant erhielten, keine Todesfälle aufgetreten, während in der Placebo-Gruppe mit 82 Patienten fünf Todesfälle zu verzeichnen waren (p-Wert von 0,02).
Eine nach einem Jahr durchgeführte explorative Analyse zeigt, dass der Überlebensvorteil weiterhin besteht. Patienten, die randomisiert 300 mg Dazucorilant erhielten, lebten signifikant länger als Patienten, die Placebo erhielten und in der Verlängerungsstudie nicht auf 300 mg Dazucorilant umgestellt wurden. Der Unterschied zwischen den Gruppen war ausgeprägt, mit einer Hazard Ratio von 0,16 (p-Wert: 0,0009). Siehe Abbildung 1.
Ein ähnlicher Überlebensvorteil wurde bei Patienten beobachtet, die 300 mg Dazucorilant über einen Zeitraum von mehr als 24 Wochen entweder in der Behandlungsphase oder in der Verlängerungsstudie erhielten, im Vergleich zu Patienten, die entweder Placebo oder 150 mg Dazucorilant über 24 Wochen erhielten und in der Verlängerungsstudie kein Dazucorilant erhielten (Hazard Ratio: 0,36; p-Wert 0,02). Siehe Abbildung 2. Die Verlängerungsstudie läuft noch.
Dazucorilant hat ein akzeptables Sicherheitsprofil gezeigt, wobei 92 Prozent der unerwünschten Ereignisse leicht bis mittelschwer waren. Die Häufigkeit schwerer und schwerwiegender unerwünschter Ereignisse bei Patienten, die Dazucorilant erhielten, war ähnlich wie bei denen, die Placebo erhielten. Leichte bis mittelschwere, dosisabhängige, vorübergehende Bauchschmerzen waren die häufigste Nebenwirkung.
"Die Verbesserung der Gesamtüberlebensrate, die erstmals in der DAZALS-Studie nach sechs Monaten festgestellt wurde, ist auch nach einem Jahr weiterhin zu beobachten. Dieses Ergebnis verdient unsere volle Aufmerksamkeit im Dienste der Patienten mit dieser tragischen Erkrankung. Fortschritte bei der Entwicklung neuer ALS-Behandlungen sind von entscheidender Bedeutung", sagte Dr. med. Leonard H. van den Berg, Professor und Vorsitzender der Abteilung für Neurologie am UMC Utrecht Brain Centre in Utrecht, Niederlande, und Hauptprüfarzt der DAZALS-Studie.
"Medikamente, die das Leben von ALS-Patienten verlängern können, werden dringend benötigt. Wir arbeiten mit den Zulassungsbehörden zusammen, um den optimalen Weg für die Weiterentwicklung von Dazucorilant zu finden", sagte Bill Guyer, PharmD, Chief Development Officer von Corcept. "Wir möchten uns bei den Patienten, ihren Familien und Pflegekräften sowie den an dieser Studie beteiligten Forschern, Ärzten und Klinikmitarbeitern bedanken."
Über die DAZALS-Studie
DAZALS ist eine randomisierte, doppelblinde, placebokontrollierte Phase-2-Studie, in der 249 ALS-Patienten im Verhältnis 1:1:1 randomisiert wurden, um 24 Wochen lang täglich entweder 150 mg Dazucorilant, 300 mg Dazucorilant oder Placebo zu erhalten. Patienten, die die Behandlungsdauer abgeschlossen hatten, konnten an der Langzeit-Verlängerungsstudie teilnehmen, in der alle Patienten 300 mg Dazucorilant erhielten. Die Ausgangsmerkmale der Patienten, darunter der ENCALS-Risikoscore, die Zeit seit der Diagnose, der ALSFRS-R-Gesamtscore und der Beginn der bulbären Symptome, waren in allen Studienarmen konsistent.
Der primäre Endpunkt der DAZALS-Studie war die Differenz der Veränderung des ALSFRS-R-Scores gegenüber dem Ausgangswert während der 24-wöchigen Behandlungsdauer zwischen Patienten, die Dazucorilant erhielten, und Patienten, die Placebo erhielten. Wichtige sekundäre Endpunkte waren die Gesamtüberlebenszeit und die Lebensqualität. Die DAZALS-Studie wurde an Standorten in Europa, den Vereinigten Staaten und Kanada durchgeführt.
Über amyotrophe Lateralsklerose (ALS)
ALS, auch bekannt als Lou-Gehrig-Syndrom oder Motoneuronerkrankung, ist eine tödliche degenerative neurologische Erkrankung, von der mehr als 55.000 Menschen in den Vereinigten Staaten und Europa betroffen sind. ALS führt zu einer Schwächung der Muskeln und beeinträchtigt im Verlauf der Erkrankung die Fähigkeit der Patienten zu sprechen, zu essen, sich zu bewegen und zu atmen. Es gibt zunehmend Hinweise darauf, dass Patienten mit ALS, insbesondere solche mit einem raschen Krankheitsverlauf, erhöhte oder abnormale Cortisolspiegel aufweisen. Die Lebenserwartung eines Patienten nach der Diagnose beträgt zwei bis fünf Jahre.
Über Dazucorilant
Dazucorilant ist ein selektiver Cortisolmodulator, der an den Glukokortikoidrezeptor bindet, aber nicht an andere Hormonrezeptoren des Körpers. Corcept untersucht es als potenzielle Behandlung für ALS und andere neurologische Erkrankungen. Dazucorilant ist ein proprietäres Produkt von Corcept und durch Patente auf die Zusammensetzung, die Verwendungsmethode und andere Aspekte geschützt. Die US-amerikanische Arzneimittelbehörde FDA hat Dazucorilant den Fast-Track-Status und den Orphan-Drug-Status für die Behandlung von ALS in den Vereinigten Staaten gewährt.
Über Corcept Therapeutics
Seit über 25 Jahren konzentriert sich Corcept auf die Cortisolmodulation und deren Potenzial zur Behandlung von Patienten mit einer Vielzahl schwerer Erkrankungen und hat mehr als 1.000 proprietäre selektive Cortisolmodulatoren und Glukokortikoidrezeptorantagonisten entdeckt. Corcept führt fortgeschrittene klinische Studien bei Patienten mit Hyperkortisolismus, soliden Tumoren, ALS und Lebererkrankungen durch. Im Februar 2012 brachte das Unternehmen Korlym auf den Markt, das erste von der US-amerikanischen Arzneimittelbehörde FDA zugelassene Medikament zur Behandlung von Patienten mit endogenem Hyperkortisolismus. Corcept hat seinen Hauptsitz in Redwood City, Kalifornien. Weitere Informationen finden Sie unter Corcept.com.
Zukunftsgerichtete Aussagen
Aussagen in dieser Pressemitteilung, die keine historischen Tatsachen darstellen, sind zukunftsgerichtete Aussagen, die auf unseren aktuellen Plänen und Erwartungen basieren und Risiken und Unsicherheiten unterliegen, die dazu führen können, dass unsere tatsächlichen Ergebnisse wesentlich von den in diesen Aussagen ausgedrückten oder implizierten Ergebnissen abweichen. Diese Risiken und Unsicherheiten sind in unseren bei der SEC eingereichten Unterlagen aufgeführt, die auf unserer Website und der Website der SEC verfügbar sind.
In dieser Pressemitteilung enthalten zukunftsgerichtete Aussagen unter anderem Aussagen zur Entwicklung von Dazucorilant als Behandlung für Patienten mit ALS, einschließlich des Tempos, der Durchführung, des Zeitplans und der Ergebnisse der DAZALS-Studie und der damit verbundenen Langzeitverlängerungsstudie sowie der Aufsicht oder Anforderungen, die von der FDA oder anderen Aufsichtsbehörden auferlegt werden können. Wir lehnen jede Absicht oder Verpflichtung zur Aktualisierung der in dieser Pressemitteilung enthaltenen zukunftsgerichteten Aussagen ab.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Originalversion auf businesswire.com ansehen: https://www.businesswire.com/news/home/20250605453863/de/
Contacts:
Anfragen von Investoren:
ir@corcept.com
Anfragen von Medien:
communications@corcept.com
www.corcept.com