Original-Research: Valneva SE - from First Berlin Equity Research GmbH
Classification of First Berlin Equity Research GmbH to Valneva SE
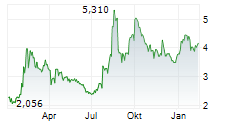
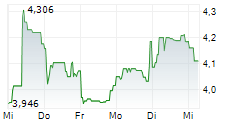
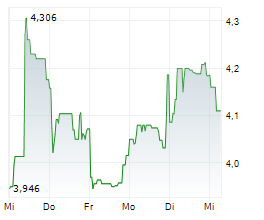
First Berlin Equity Research has published a research update on Valneva SE (ISIN: FR0004056851). Analyst Simon Scholes reiterated his BUY rating and decreased the price target from EUR 8.10 to EUR 6.30. Abstract: The FDA has suspended the license for Valneva's chikungunya vaccine, IXCHIQ, for all age groups (presumably permanently), citing four new serious adverse events (SAEs) consistent with chikungunya-like illness. In May, following reports of SAEs, mainly in elderly people with several underlying medical conditions, both the European Medicines Agency (EMA) and the FDA paused the use of IXCHIQ in this age group. The agencies lifted these restrictions in July and August respectively after noting that IXCHIQ is contraindicated in individuals with a weakened immune system due to disease or immunosuppressive treatments. In our view, the rally in Valneva's share price from early July to 22 August (+113%) was based in large part on lifting of restrictions on IXCHIQ and the expectations of substantial orders for the vaccine to address the outbreak of chikungunya currently affecting parts of Africa, South East Asia, France and Italy. The EMA has so far not made any statement on the additional SAEs, but the FDA suspension may cause hesitancy in ordering IXCHIQ outside the U.S. and boost the market share of the competing chikungunya vaccine, Bavarian Nordic's VIMKUNYA. However, prospects for Valneva's Lyme disease vaccine candidate, VLA15, remain intact. The VLA15 phase 3 trial is set to read out either late this year or in early 2026. We expect the annual value of the Lyme vaccine market to peak at over USD2bn. Subject to positive phase 3 data and regulatory approval, Pfizer plans to launch VLA15 in autumn 2027. We expect commercialisation of VLA15 to trigger aggregate milestone payments to Valneva of USD143m from partner Pfizer in 2027. Additionally, Valneva also stands to receive USD100m in commercial milestones based on cumulative VLA15 sales thresholds, and royalties of between 14% and 22%. No vaccine is currently available to prevent Lyme disease in humans. We maintain our Buy recommendation but have reduced the price target to €6.30 (previously: €8.10) to reflect downward revisions to our IXCHIQ sales forecasts (Upside: 60%). First Berlin Equity Research hat ein Research Update zu Valneva SE (ISIN: FR0004056851) veröffentlicht. Analyst Simon Scholes bestätigt seine BUY-Empfehlung und senkt das Kursziel von EUR 8,10 auf EUR 6,30. Zusammenfassung: Die FDA hat die Zulassung für Valnevas Chikungunya-Impfstoff IXCHIQ für alle Altersgruppen (vermutlich dauerhaft) ausgesetzt und dabei vier neue schwerwiegende unerwünschte Ereignisse (SAEs) angeführt, die mit einer Chikungunya-ähnlichen Erkrankung übereinstimmen. Im Mai, nach Berichten über SAEs, vor allem bei älteren Menschen mit mehreren Grunderkrankungen, haben sowohl die Europäische Arzneimittelagentur (EMA) als auch die FDA die Verwendung von IXCHIQ in dieser Altersgruppe ausgesetzt. Die Behörden hoben diese Beschränkungen im Juli bzw. August auf, nachdem sie festgestellt hatten, dass IXCHIQ bei Personen mit einem geschwächten Immunsystem aufgrund von Krankheiten oder immunsuppressiven Behandlungen kontraindiziert ist. Unserer Ansicht nach beruhte der Anstieg des Aktienkurses von Valneva von Anfang Juli bis zum 22. August (+113%) zum großen Teil auf der Aufhebung der Beschränkungen für IXCHIQ und den Erwartungen hinsichtlich umfangreicher Bestellungen des Impfstoffs zur Bekämpfung des aktuellen Ausbruchs von Chikungunya, von dem derzeit Teile Afrikas, Südostasiens, Frankreichs und Italiens betroffen sind. Die EMA hat bisher keine Stellungnahme zu den zusätzlichen SAEs abgegeben, aber die Aussetzung durch die FDA könnte zu Zurückhaltung bei der Bestellung von IXCHIQ außerhalb der USA führen und den Marktanteil des konkurrierenden Chikungunya-Impfstoffs VIMKUNYA von Bavarian Nordic steigern. Die Aussichten für Valnevas Impfstoffkandidaten VLA15 gegen Lyme-Borreliose bleiben jedoch unverändert. Die Ergebnisse der Phase-3-Studie zu VLA15 sollen entweder Ende dieses Jahres oder Anfang 2026 vorliegen. Wir gehen davon aus, dass der Jahresumsatz des Marktes für Lyme-Impfstoffe einen Höchststand von über USD2 Mrd. erreichen wird. Vorbehaltlich positiver Phase-3-Daten und der behördlichen Zulassung plant Pfizer, VLA15 im Herbst 2027 auf den Markt zu bringen. Wir gehen davon aus, dass die Vermarktung von VLA15 im Jahr 2027 zu Meilensteinzahlungen in Höhe von insgesamt USD143 Mio. von Partner Pfizer an Valneva führen wird. Darüber hinaus wird Valneva voraussichtlich USD100 Mio. an kommerziellen Meilensteinzahlungen auf Basis der kumulierten VLA15-Umsatzschwellen sowie Lizenzgebühren zwischen 14% und 22% erhalten. Derzeit gibt es keinen Impfstoff zur Vorbeugung der Lyme-Borreliose beim Menschen. Wir behalten unsere Kaufempfehlung bei, haben jedoch das Kursziel auf €6,30 (zuvor:€ 8,10) gesenkt, um die Abwärtskorrekturen unserer IXCHIQ-Umsatzprognosen widerzuspiegeln. Aufwärtspotenzial: 60%. Bezüglich der Pflichtangaben gem. §85 Abs. 1 S. 1 WpHG und des Haftungsausschlusses siehe die vollständige Analyse. You can download the research here: VLA_FP-2025-08-26_EN Contact for questions: First Berlin Equity Research GmbH Herr Gaurav Tiwari Tel.: +49 (0)30 809 39 686 web: www.firstberlin.com E-Mail: g.tiwari@firstberlin.com The EQS Distribution Services include Regulatory Announcements, Financial/Corporate News and Press Releases. | ||||||||||||||||||||
2188730 26.08.2025 CET/CEST
© 2025 EQS Group