DJ Fresenius' Denosumab-Biosimilar-Kandidaten vor EU-Zulassung
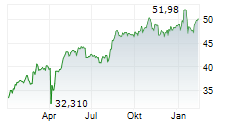
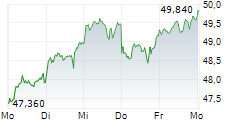
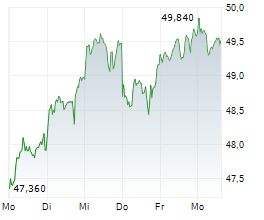
DOW JONES--Fresenius kann einen weiteren Erfolg für sein wachstumsstarkes Biopharma-Geschäft verbuchen. Wie der Gesundheitskonzern mitteilte, hat der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) eine positive Stellungnahme zu den Denosumab-Biosimilar-Kandidaten für die Behandlung von Osteoporose und anderen Knochenerkrankungen abgegeben. Die Empfehlung gilt für sämtliche Indikationen der Referenzprodukte Prolia und Xgeva von Amgen. Die Europäischen Kommission folgt bei ihrer Zulassungsentscheidung in der Regel den Empfehlungen des CHMP.
In den USA sind die Denosumab-Biosomilars "Conexxence" und "Bomyntra" bereits Ende März zugelassen worden. Durch einen Vergleich mit Amgen ist die Vermarktung der Denosumab-Biosimilars in den USA ab Mitte 2025 und in Europa im zweiten Halbjahr möglich.
Kontakt zum Autor: unternehmen.de@dowjones.com
DJG/brb/kla
(END) Dow Jones Newswires
May 27, 2025 04:32 ET (08:32 GMT)
Copyright (c) 2025 Dow Jones & Company, Inc.